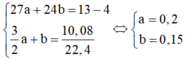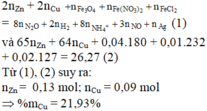Câu 26. Hòa tan 4 gam hỗn hợp gồm zinc (kẽm) Zn và copper (đồng) Cu vào lượng dư dung dịch HCl, giải phóng 0,4958 lít khí hydrogen H2 (25oC, 1 bar). Phần trăm khối lượng của kim loại copper (đồng) Cu trong hỗn hợp là
A. 67,50%. B. 32,50%. C. 64,03% D. 35,97%.
Câu 27. Dãy chất nào sau đây gồm các oxit tác dụng được với dung dịch potassium hydroxide KOH?
A. BaO, Na2O, SO2
B. Fe2O3, BaO, ZnO
C. CO2, SO2, P2O5
D. ZnO, CaO, N2O5
Câu 28. Dùng chất nào sau đây để phân biệt được 2 chất bột Na2CO3 và NaCl
A. H2O
B. dung dịch HCl
C. dung dịch NaCl
D. CO2
Câu 29. Phản ứng giữa hai chất nào sau đây dùng để điều chế khí sunfurdioxide trong phòng thí nghiệm?
A. Na2SO3 và H2SO4
B. Na2SO3 và Ca(OH)2
C. S và O2 (đốt S)
D. FeS2 và O2 (đốt quặng pirit sắt)
Câu 30. Cặp chất nào sau đây không thể cùng tồn tại trong một dung dịch?
A. HCl, KCl
B. K2SO4 và AgNO3
C. H2SO4 và BaO
D. NaNO3 và H2SO4